延长晚期乳腺癌患者生存期的新药Orserdu(elacestrant)
2023年1月27日,美国FDA批准治疗晚期乳腺癌的新药——elacestrant(商品名:Orserdu)上市,这给乳腺癌治疗药物大军中添加了一员“虎将”。
根据Orserdu的3期EMERALD试验数据,与其他标准内分泌单药治疗(氟维司群或一种芳香化酶抑制剂)相比,Orserdu在无进展生存期(PFS)方面具有临床上的显著改善,在228例
因此,Orserdu的获批上市为晚期乳腺癌患者带来了福音!
什么是Orserdu(elacestrant)?
Orserdu(elacestrant)治疗效果如何?
elacestrant获批是基于3期EMERALD试验的研究结果。
EMERALD试验主要终点是无进展生存期
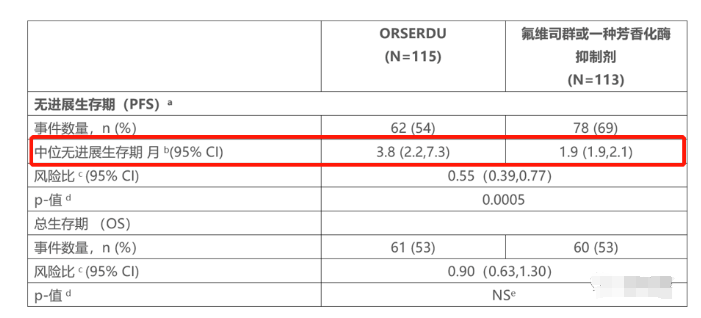
(小知识:EMERALD试验
Orserdu(elacestrant)推荐剂量与服用方法?
1 推荐剂量:
每次345mg,每日一次,与食物一起服用,持续服用直至疾病进展或出现不可耐受的毒性。
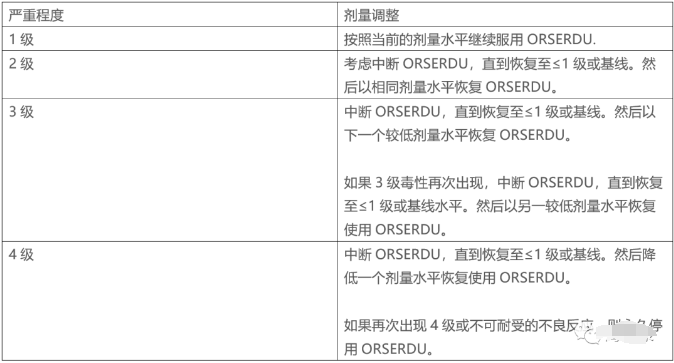
2 剂量调整:
表1列出了不良反应的建议剂量减少方案:

表2提供了针对各等级不良反应的推荐剂量调整。
3 肝损伤的剂量调整
-严重肝损害患者(Child-Pugh C)禁止使用ORSERDU
-对于中度肝损伤患者(Child-Pugh B),将ORSERDU剂量降至258 mg,每日一次
-轻度肝损害患者无需调整剂量(Child-Pugh A)
4 服用方法:
Orserdu(elacestrant)常见副作用有哪些?
最常见(>10%)的不良反应,包括实验室化验结果异常、肌肉骨骼疼痛、恶心、胆固醇升高、AST升高、甘油三酯升高、疲劳、血红蛋白降低、呕吐、ALT升高、血钠降低、肌酐升高、食欲下降、腹泻、头痛、便秘、腹痛、潮热和消化不良。
1 特殊人群:
妊娠期:根据动物研究结果及其作用机制,本品给孕妇服用时可能会造成胎儿伤害。
哺乳期:建议女性在使用本品治疗期间以及最终剂量后至少1周内不要母乳喂养。
儿童:尚未确定本品对儿童患者的安全性和有效性。
老年患者:
在EMERALD试验中接受ORSERDU治疗的237名患者中,43%为65岁或以上,17%为75岁或以上。65岁或65岁以上的患者与年轻患者相比,ORSERDU的安全性或有效性无总体差异。75岁或以上的患者数量不足,无法评估安全性或有效性是否存在差异。
肝损伤患者:
严重肝损害患者(Child-Pugh C)应避免使用ORSERDU。中度肝损害患者(Child-Pugh B)降低ORSERDU剂量。不建议轻度肝损害患者(Child-Pugh A)调整剂量。(详见上面肝损伤的剂量调整)
2 注意事项:
-血脂异常:ORSERDU可能导致高胆固醇血症和高甘油三酯血症。开始治疗前和治疗后定期监测血脂情况。
-胚胎-胎儿毒性:ORSERDU可导致胎儿伤害。告知患者本品对胎儿的潜在风险,并建议采取有效的避孕措施。
以上药物信息仅供参考,服药时,请谨遵医嘱!
