减肥药Zepbound(tirzepatide,替西帕肽)现已在美国上市
礼来公司于12月5日宣布Zepbound(tirzepatide,替西帕肽)已在美国药店上市,适用于作为低热量饮食和增加体力活动的辅助手段,用于初始体重指数(BMI)为30kg/m²或更高(肥胖)的成年人进行长期体重管理;或27kg/m²或以上(超重)且存在至少1种与体重相关合并症(例如,高血压、2型糖尿病、血脂异常、阻塞性睡眠呼吸暂停或心血管疾病)。
Zepbound通过激活体内两种自然产生的激素来发挥作用:胰高血糖素样肽1(GLP-1),和葡萄糖依赖性促胰岛素多肽(GIP)。据说这种组合可以减缓胃的排空,使饱腹感持续更长时间,并通过减缓大脑中的饥饿信号来抑制食欲。
此次批准基于两项为期72周、双盲、安慰剂对照的3期试验的数据:SURMOUNT-1(NCT04184622)和SURMOUNT-2(NCT04657003)。两项研究的结果均表明,与安慰剂相比,接受Zepbound治疗的患者体重显著减轻。
安全性方面,Zepbound最常见的不良反应是恶心、腹泻、呕吐、便秘、腹痛、消化不良、注射部位反应、疲劳、过敏反应、嗳气、脱发和胃食管反流病。
注意,Zepbound的处方信息还包括有关甲状腺C细胞肿瘤风险的黑框警告;有甲状腺髓样癌个人史或家族史的患者或多发性内分泌肿瘤综合征2型患者禁用Zepbound。Zepbound不应与其他含替西帕肽的制品或任何其他GLP-1受体激动剂联合使用。与其他减肥制品联合使用的安全性和有效性尚未确定。

Zepbound尚未在有胰腺炎病史的患者中进行研究。该标签还包括与严重胃肠道疾病、急性肾损伤、急性胆囊疾病、急性胰腺炎、超敏反应、低血糖、2型糖尿病患者的糖尿病视网膜病变并发症以及自杀行为和意念相关的警告和预防措施。
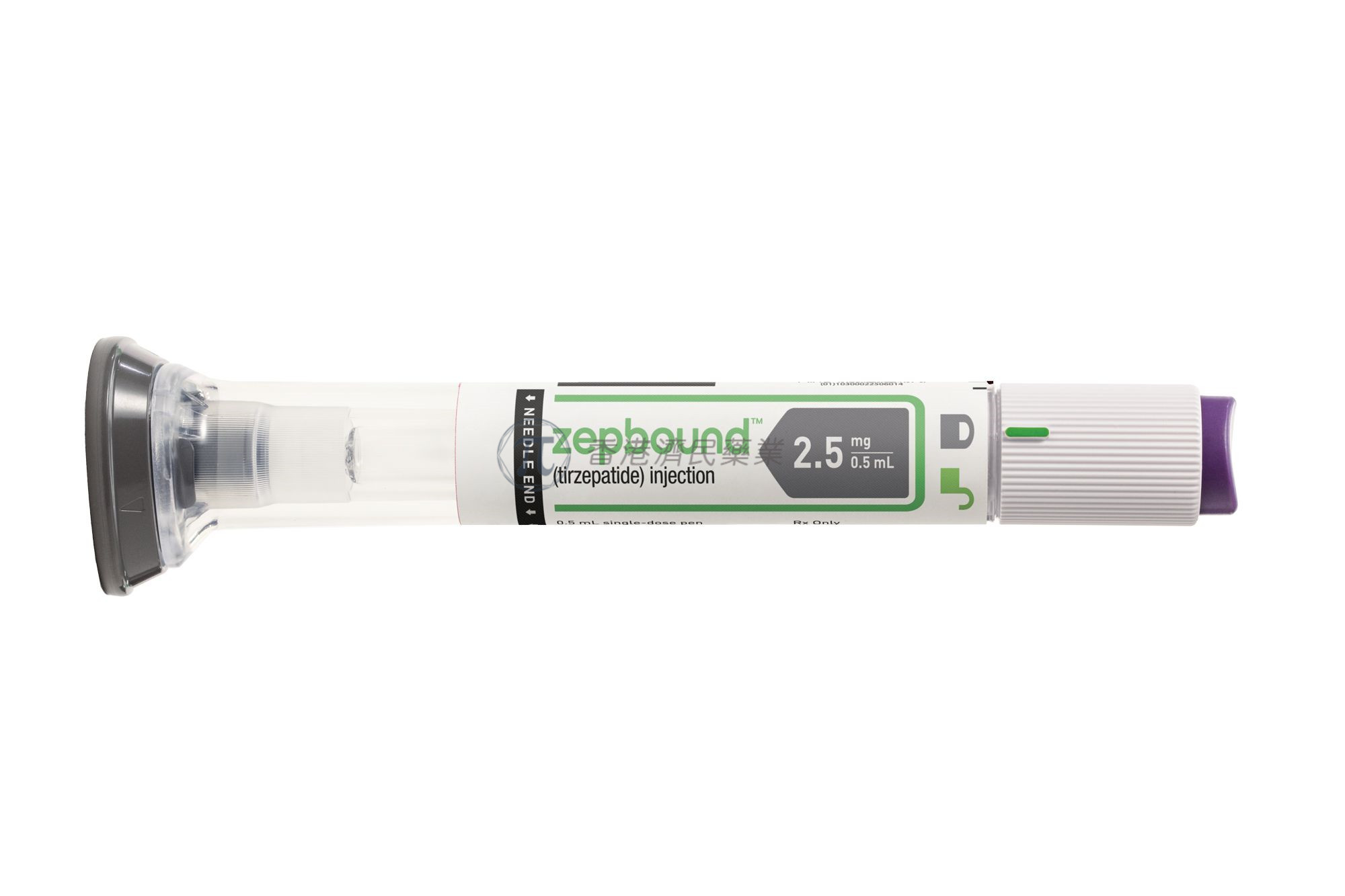
礼来表示,Zepbound以预装单剂量笔的形式提供,剂量为2.5mg、5mg、7.5mg、10mg、12.5mg或15mg。应根据患者的BMI选择治疗方案。推荐的起始剂量是每周一次皮下注射(SC)2.5mg。2.5mg剂量用于开始治疗,不适用于长期体重管理。患者或护理人员在接受适当的皮下注射技术培训后即可给药。
参考来源:
Zepbound™ (tirzepatide) is now available in U.S. pharmacies for adults living with obesity. News release. Lilly. December 5, 2023.
注:以上资讯来源于网络,由双效网整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
Zepbound™ (tirzepatide) is now available in U.S. pharmacies for adults living with obesity. News release. Lilly. December 5, 2023.
注:以上资讯来源于网络,由双效网整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
公司团队拥有十多年的跨境贸易服务经验,包括印度代购跑腿经验/孟加拉代购跑腿经验/老挝代购跑腿经验/日本代购跑腿经验/土耳其代购跑腿经验/美国代购跑腿经验/德国代购跑腿经验。现在时替西帕肽国内代理服务商,为朋友提供替西帕肽代购跑腿服务。
请联系微信:799887580或306248824或者2573909181。联系QQ:799887580或306248824
