礼来口服GLP-1RA orforglipron平均减重降幅高达12.4kg
8月7日,礼来宣布了3期临床研究ATTAIN-1的积极顶线结果。该研究在3,127名肥胖或至少伴有一种体重相关合并症的超重但无糖尿病的成人中,评估了在研胰高血糖素样肽 - 1(GLP-1)受体激动剂orforglipron。在第72周时,orforglipron的三个剂量组与安慰剂组相比均达到了主要终点和所有关键次要终点,在饮食控制和运动的基础上orforglipron实现了具有临床意义的体重减轻。对于主要终点,每日一次且在对饮食和饮水不加以限制的前提下,orforglipron 36mg体重降幅高达12.4%,而安慰剂组为0.9%(使用有效性估计目标)。1 声明: 1. Orforglipron为研究中的药品,尚未在中国获批 2. 礼来不推荐任何未获批的药品/适应症使用
礼来执行副总裁 心血管代谢健康事业部总裁 Kenneth Custer博士 肥胖是当下最紧迫的全球健康挑战之一,加剧了全球慢性疾病负担并影响全球超过10亿人,通过研发orforglipron, 我们尝试推出每日一次口服疗法,为肥胖治疗带来变革,不仅有助于早期干预和长期疾病管理,同时也为患者提供了一种便捷的治疗选择,作为注射治疗的替代方案。凭借这些积极的研究数据,我们目前正计划于今年年底前提交orforglipron用于监管审评,并已做好其在全球上市的准备,以应对这一紧迫的公共健康需求。
礼来集团副总裁兼中国总经理 德赫兰女士 在中国,超重或肥胖成人患者将近5亿,肥胖所带来的社会负担日益趋重。Orforglipron作为一种每日一次的口服药物,无需冷藏,将大幅提升肥胖治疗的便捷性和药物的可及性。我们期待这一创新药物能够早日惠及中国患者,进一步助力‘体重管理年’行动,减轻肥胖疾病负担。
礼来全球高级副总裁 礼来中国药物开发及医学事务中心负责人 王莉博士 我们很高兴看到我们最新的肠促胰素类药物orforglipron在ATTAIN-1研究中显示出了显著的减重效果,其安全性也与现有的注射类GLP-1受体激动剂一致。该研究还广泛纳入了中国患者,是中国同步研发的体现。作为全球首个完成肥胖3期研究的口服小分子非肽类GLP-1受体激动剂,orforglipron服用上不受饮食和饮水限制,为患者提供了更加便捷,灵活的治疗选择,有望满足患者治疗方式上的多元需求。
在ATTAIN-1研究中,orforglipron达到了主要终点,即与安慰剂相比,orforglipron实现了更显著的体重减轻。使用有效性估计目标,在第72周时,orforglipron最高剂量组平均减重12.4kg(12.4%)。在一项关键次要终点中,orforglipron最高剂量组体重减轻≥10%的参与者比例达59.6% ,体重减轻≥15%的参与者比例达39.6% 。除了实现显著的体重减轻外,orforglipron还显示出与已知的心血管风险标志物的降低相关,包括在所有剂量的汇总分析中的非高密度脂蛋白胆固醇、甘油三酯及收缩压。在一项预设的探索性分析中,orforglipron最高剂量组降低高敏 C 反应蛋白(hsCRP) 水平达47.7%。
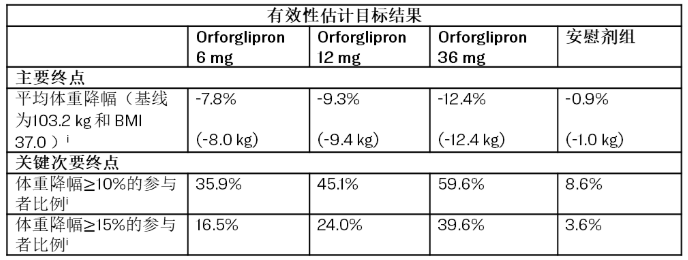
i 优效性检验经过多重性调整。
对于治疗方案估计目标2,orforglipron每个剂量组在主要终点和所有关键次要终点上,均实现了具有统计学意义的改善。 体重减轻百分比: -7.5%(-7.8kg;6mg)、-8.4%(-8.6kg;12mg)、-11.2%(-11.3kg;36mg)、-2.1%(-2.4kg;安慰剂) 体重减轻 ≥10% 的参与者比例:33.3%(6mg)、40.0%(12mg)、54.6%(36mg)、12.9%(安慰剂) 体重减轻 ≥15% 的参与者比例:15.1%(6mg)、20.3%(12mg)、36.0%(36mg)、5.9%(安慰剂) 在ATTAIN-1研究中,orforglipron的整体安全性与GLP-1RA类药物一致。最常见的不良反应是胃肠道反应,通常为轻至中度。接受orforglipron (6mg、12mg和36mg)的参与者中最常见的不良事件分别为:恶心(28.9%、35.9%、33.7%)vs. 安慰剂组10.4%;便秘(21.7%、29.8%、25.4%)vs.安慰剂组9.3%;腹泻(21.0%、22.8%、23.1%)vs. 安慰剂组9.6%;呕吐(13.0%、21.4%、24.0%)vs. 安慰剂组 3.5%;消化不良(13.0%、16.2%、14.1%)vs. 安慰剂组5.0%。Orforglipron由于不良事件导致的治疗中断率分别为:6mg组5.1%、12mg组7.7%、36mg组10.3%,安慰剂组为2.6%。Orforglipron总体治疗中断率分别为:6mg组21.9%、12mg组22.5%、36mg组24.4%,安慰剂组为29.9%。未观察到肝脏安全性信号。 ATTAIN-1 研究的详细结果将于下个月在 2025 年欧洲糖尿病研究协会(EASD)年会上公布,并将在同行评审的期刊上发表。预计将于今年年底前公布ATTAIN 3 期临床研究系列项目的更多结果,以及orforglipron用于成人2型糖尿病患者的ACHIEVE 3 期临床研究系列项目的结果。 Orforglipron是一种在研的、每日一次口服的小分子(非肽类)胰高血糖素样肽 – 1受体激动剂(GLP-1 RA)。该药物可在全天任何时间服用,对饮食和饮水不加以限制。3该药物由中外制药(Chugai Pharmaceutical Co., Ltd.)发现,并于2018年授权至礼来公司开发。中外制药与礼来共同发表了这一分子的临床前药理学数据。4目前,礼来正在进行orforglipron用于治疗2型糖尿病,以及用于肥胖或至少伴有一种体重相关合并症的超重成人进行体重管理的系列3期研究。此外,礼来还在探索orforglipron作为治疗肥胖成人的阻塞性睡眠呼吸暂停和高血压的潜在可能。
ATTAIN-1(NCT05869903)是一项为期72周的随机、双盲、安慰剂对照的3期研究,旨在比较orforglipron 6mg、12mg和36mg单药治疗与安慰剂相比,在肥胖或伴有至少一种合并症(高血压、血脂异常、阻塞性睡眠呼吸暂停或心血管疾病)但无糖尿病的超重成人中的有效性和安全性。该研究在美国、巴西、中国、印度、日本、韩国、波多黎各、斯洛伐克、西班牙和中国台湾共入组了3127名参与者,并按照3:3:3:4的比例随机分配,接受6mg、12mg 或36mg的orforglipron或安慰剂治疗。该研究的主要目的是证明在BMI≥30.0kg/m²或BMI≥27.0kg/m² 且至少伴有一种体重相关合并症及至少有一次自我报告节食减肥失败史的参与者中,治疗第72周时,orforglipron(6mg、12mg、36mg)组体重较基线的降幅优于安慰剂组。所有接受orforglipron治疗的参与者均以1mg每日一次的剂量起始,每四周增加一次剂量,直至达到最终随机维持剂量:6mg(从1mg起始)、12mg(从1mg起始、增至3mg ,再至6mg )或36mg(从1mg起始、增至3mg、再至6mg、12mg和24mg )。仅在出现胃肠道耐受性问题且无法缓解的情况下,才允许减少剂量。
