卢修斯阿达格拉西布(Adagrasib)中文说明书详情!
阿达格拉西布

适应症
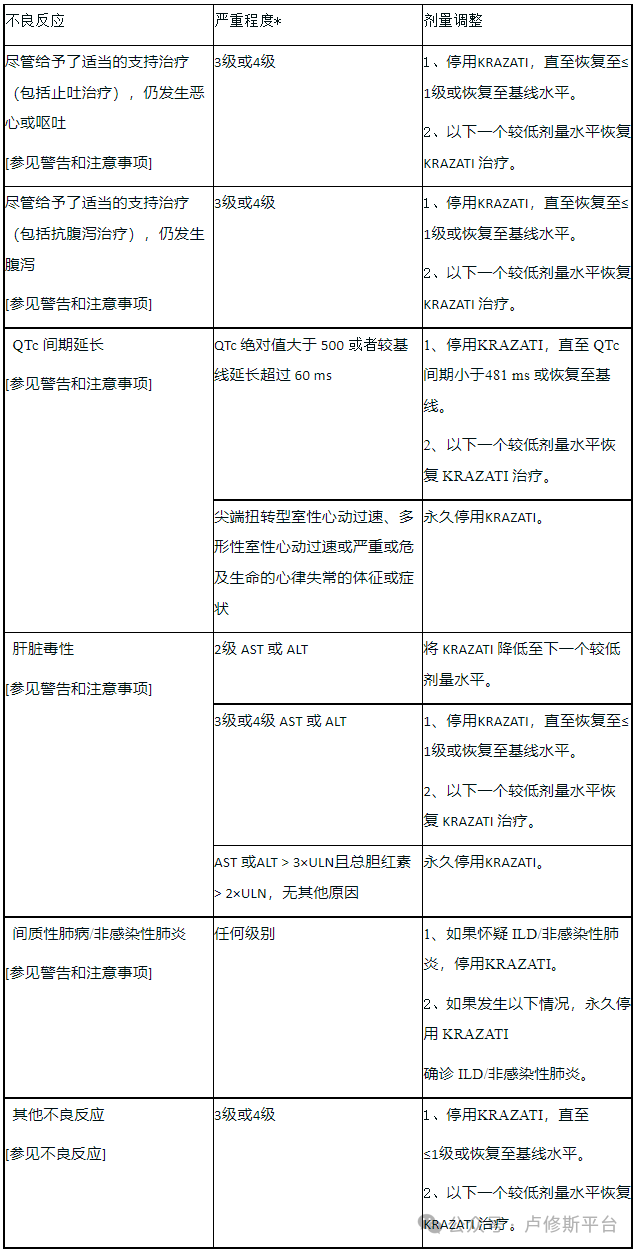
阿达格拉西布是RAS GTPase抑制剂,适用于治疗KRAS G12C突变的局部晚期或转移性非小细胞肺癌癌症(NSCLC)的成年患者,这些患者之前至少接受过一次全身治疗。 用法用量 1、患者选择 基于血浆或肿瘤标本中存在 KRASG12C 突变,选择接受 LuciAda 治疗的局部晚期或转移性 NSCLC 患者。如果在血浆标本中未检测到突变,则检测肿瘤组织。 关于 FDA 批准用于检测 KRASG12C 突变的检测方法的信息,可参见https://www.fda.gov/CompanionDiagnostics LuciAda 的推荐剂量为 600 mg 口服给药,每日两次,直至疾病进展或出现不可接受的毒性。 每天同一时间与或不与食物同服 LuciAda。整片吞服。请勿咀嚼、压碎或掰开片剂。 如果服用 LuciAda 后发生呕吐,请勿服用额外剂量。在下一个计划时间恢复给药。 如果因疏忽漏服一剂药物,如果已超过预期给药时间4小时,则应跳过该剂药物。在下一个计划时间恢复给药。 3、针对不良反应的剂量调整 不良反应的推荐剂量降低见表1。如果发生不良反应,最多允许减量2次。无法耐受 600 mg 每日一次的患者永久停用LuciAda。 表1:针对不良反应的 LuciAda 减量建议 针对不良反应的推荐剂量调整见表2。 表2:针对不良反应的 LuciAda 剂量调整建议 ALT = 丙氨酸氨基转移酶;AST = 天冬氨酸氨基转移酶;ULN = 正常值上限 *根据美国国家癌症研究所不良事件通用术语标准 (NCI CTCAE)5.0版定义的分级
2、推荐剂量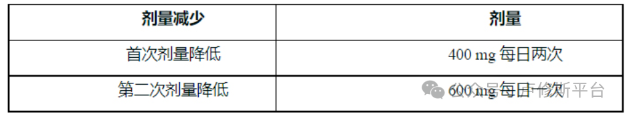
特殊人群用药 1、妊娠 风险总结 尚无妊娠女性使用 KRAZATI 的可用数据。在动物生殖研究中,在器官形成期间对妊娠大鼠和兔经口给予低于人体暴露量(推荐剂量为 600 mg 每日两次)的 adagrasib 时,未引起不良发育影响或胚胎-胎仔死亡(参见数据)。 在美国一般人群中,临床确认的妊娠中重大出生缺陷和流产的估计背景风险分别为2%-4%和15%-20%。 数据 动物数据 在大鼠胚胎-胎仔发育研究中,在器官形成期间每日一次对妊娠大鼠经口给予adagrasib,在 270 mg/kg 剂量水平(基于体表面积 [BSA],约为推荐剂量 600 mg 每日两次的2倍)下导致母体毒性(体重和摄食量减少,以及导致濒死状态和提前处死的不良临床体征)和胎仔体重降低。Adagrasib诱导骨骼。 270 mg/kg 剂量下观察到的畸形(如四肢弯曲)和骨骼变异(如肩胛骨弯曲、波状肋骨和多余的短颈肋骨)继发于母体毒性和胎仔体重降低。 在兔胚胎-胎仔发育研究中,器官形成期间每日一次经口给予adagrasib,在30 mg/kg(基于临床剂量 600 mg 每日两次的曲线下面积 [AUC],约为人体暴露量的0.11倍)下导致胎仔体重降低和未骨化胸骨的窝频率增加。这种骨骼变异与母体毒性相关,包括平均体重降低和摄食量减少。在剂量高达 30 mg/kg 每日一次时,Adagrasib暴露未引起不良发育影响,也未影响家兔的胚胎-胎仔存活率。 2、哺乳期 风险总结 尚无关于人乳汁中存在 adagrasib 或其代谢物、对母乳喂养婴儿或乳汁生成影响的数据。由于母乳喂养儿童可能发生严重不良反应,建议女性在 KRAZATI 治疗期间和末次给药后1周内不要哺乳。 3、有生育能力的女性和男性 不孕症 基于动物研究的结果,KRAZATI可能损害有生育能力的女性和男性的生育力。 4、儿童用药 尚未确定 KRAZATI 在儿科患者中的安全性和有效性。 5、老年患者用药 在 KRYSTAL-1 中接受 adagrasib 600 mg 口服给药每日两次的116例患者中,49%(57例患者)的年龄≥65岁。在老年和年轻患者之间未观察到安全性或有效性的总体差异。
药物相互作用 1、其他药物对 LuciAda 的影响 (1)、强效 CYP3A4 诱导剂 避免 LuciAda 与强效 CYP3A 诱导剂合并使用。 Adagrasib 是一种 CYP3A4 底物。LuciAda与强效 CYP3A 诱导剂合并使用可降低 adagrasib 的暴露量 [见临床药理学 (12.3)],这可能会降低 LuciAda 的有效性。 (2)、强效 CYP3A4 抑制剂 避免 LuciAda 与强效 CYP3A 抑制剂合并使用,直至 adagrasib 浓度达到稳态(约8天后)。 Adagrasib 是一种 CYP3A4 底物。如果 adagrasib 浓度尚未达到稳态,则伴随使用强效 CYP3A 抑制剂将增加 adagrasib 浓度 [参见临床药理学 (12.3)],这可能增加 LuciAda 不良反应的风险。 2、LuciAda 对其他药物的影响 (1)、敏感 CYP3A 底物 除非这些底物的处方信息中另有建议,否则避免 LuciAda 与敏感 CYP3A 底物合并使用。 Adagrasib 是一种 CYP3A 抑制剂。与 LuciAda 合并使用增加了 CYP3A 底物的暴露量,这可能增加与这些底物相关的不良反应的风险。 (2)、CYP2C9 敏感底物 避免 LuciAda 与 CYP2C9 敏感底物合并使用,其中最小浓度变化可能导致严重不良反应,除非这些底物的处方信息中另有建议。 Adagrasib 是一种 CYP2C9 抑制剂。与 LuciAda 合并使用增加了 CYP2C9 底物的暴露,这可能增加与这些底物相关的不良反应的风险。 (3)、CYP2D6 敏感底物 除非这些底物的处方信息中另有建议,否则避免 LuciAda 与 CYP2D6 敏感底物合并使用,其中浓度微小变化可能导致严重不良反应。 Adagrasib 是一种 CYP2D6 抑制剂。与 LuciAda 合并使用增加了 CYP2D6 底物的暴露,这可能增加与这些底物相关的不良反应的风险。 (4)、P-gp 底物 避免 LuciAda 与 P-gp 底物合并使用,其中最小浓度变化可能导致严重不良反应,除非这些底物的处方信息中另有建议。 Adagrasib 是一种 P-gp 抑制剂。与 LuciAda 合并使用增加了 P-gp 底物的暴露量,这可能增加与这些底物相关的不良反应的风险。 3、延长 QTc 间期的药物 避免 LuciAda 与已知可能延长 QTc 间期的其他产品合并使用。如果无法避免伴随用药,则在开始 LuciAda 治疗前、伴随用药期间和有临床指征时监测心电图和电解质 [参见警告和注意事项]。如果 QTc 间期 > 500 ms或较基线变化 > 60 ms,则停用 LuciAda [见用法用量]。 Adagrasib 可导致 QTc 间期延长。LuciAda与延长 QTc 间期的其他产品合并使用可能导致 QTc 间期大幅延长以及与 QTc 间期延长相关的不良反应,包括尖端扭转型室性心动过速、其他严重心律失常和猝死 [参见警告和注意事项]。
禁忌 1、KRAZATI 在68°F-77°F(20°C-25°C) 室温下储存。 2、KRAZATI 装于儿童安全容器中。 3、KRAZATI 的容器中含有干燥剂(干燥剂),可保持药物干燥。开封后,请勿从容器中取出干燥剂。请勿进食或吞咽干燥剂。 4、将 KRAZATI 和所有药品放置在儿童接触不到的地方。
形状 片剂(Tablets)
贮存方法 贮存于20°C ~25°C (68°C ~77°F);允许范围为15~30°C (59–86°F)温度条件下短途运输。
