替尔泊肽在华申报第四项上市申请
2024年11月22日,礼来公司(Eli Lilly)开发的新型糖尿病治疗药物替尔泊肽注射液,其新适应症的上市申请已获得中国药品审评中心(CDE)的受理。此次礼来公司提交了4项注册申请,均属于境外已上市药物在中国的上市申请,分类为5.1。业界普遍推测,此次获批的适应症可能是在饮食控制和运动的基础上,联合基础胰岛素,用于改善成人2型糖尿病患者(T2DM)的血糖控制。根据CDE官网,这是替尔泊肽在华递交的第四项上市申请。
▍关于替尔泊肽
替尔泊肽是一种含有C20脂肪酸链的氨基酸序列,能够与白蛋白结合,从而延长其在体内的半衰期。该药物对人类胰高血糖素依赖性胰岛素释放肽(GIP)和胰高血糖素样肽-1(GLP-1)受体具有高度选择性和高亲和力,能有效调节食欲,减少食物摄入,进而实现减重和减脂的效果。
替尔泊肽的安全性和有效性已经得到了大量临床试验的验证。2022年,该药物首次获得美国食品药品监督管理局(FDA)批准,用于治疗2型糖尿病。2023年11月,FDA进一步批准替尔泊肽作为减肥药物上市,商品名为Zepbound,适用于治疗肥胖(BMI≥30)或超重(BMI≥27,且伴有至少一种体重相关疾病,如高血压、2型糖尿病或高胆固醇)的成年人。
▍替尔泊肽在中国的临床批准
2024年5月21日,替尔泊肽在中国获得批准,用于改善成年2型糖尿病患者的血糖控制。同年7月19日,该药物在中国作为减肥药成功上市,用于在低热量饮食和增加运动的基础上,改善成人肥胖或伴有至少一种体重相关疾病的超重患者的长期体重管理。
截至目前,替尔泊肽在中国的临床试验默示许可已达到66项,涵盖的适应症包括2型糖尿病、2型糖尿病合并高危心血管风险治疗、超重或肥胖患者的长期体重管理,以及中重度阻塞性睡眠呼吸暂停(OSA)等。
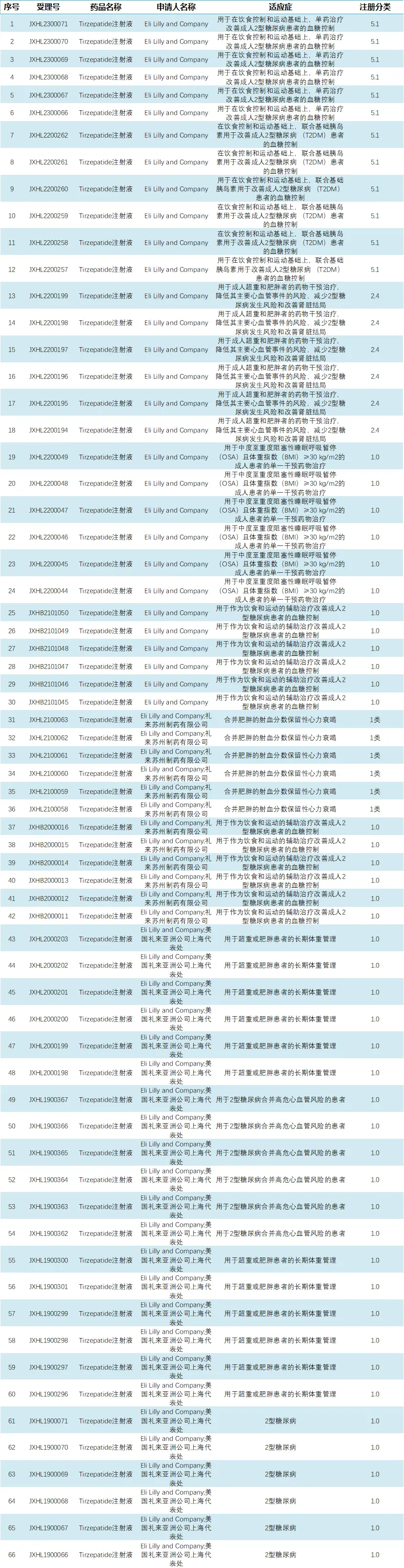
此外,替尔泊肽在中国药品审评中心(CDE)的受理信息已有28条,时间跨度近3年。根据申报药物注册分类,此次礼来公司申报的新适应症可能涉及在饮食控制和运动的基础上,联合基础胰岛素,用于改善成人2型糖尿病患者的血糖控制。
11月13日,礼来公司公布了III期SURMOUNT-1研究的详细结果。研究周期长达176周,是替尔泊肽迄今为止进行的最长期研究。研究结果显示,与安慰剂组相比,每周接受替尔泊肽(剂量分别为5mg、10mg、15mg)注射的糖尿病前期肥胖或超重成人患者,其发展为2型糖尿病的风险显著降低。在为期三年的治疗中,15mg剂量的替尔泊肽显示出持续的体重减轻效果,患者平均体重下降了22.9%。
